Thomson modellje
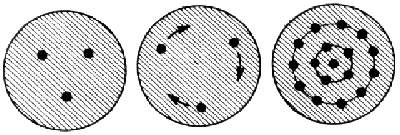
Az első neveztes atommodellt Thomson alkotta meg 1904. A katódsugarakkal végzett kísérletei alapján arra a következtetésre jutott, hogy az elektron minden anyagnak része. Mivel azonban az atom semleges, ezért pozitív töltést is kell tartalmaznia. Thomson az atomot úgy képzelte el, mint egy folytonos eloszlású pozitív részecskét, amelynek belsejében negatív töltésű, pontszerű elektronok vannak, melyek elhelyezkedését az atomban Thomson a klasszikus elektrodinamika alapján határozta meg. Eszerint az elektronok az atom középpontjára nézve szimmetrikusan helyezkednek el. Ha az atom sok elektront tartalmaz, akkor koncentrikus gyűrűket jelent. Ez már magában rejti az elektronok héjszerkezetét. Ha az atom egyensúlyát egy külső erő megzavarja, akkor az elektronok rezegni kezdenek és fényt bocsátanak ki. A modellt később mazsolás pudingnak nevezték el. Segítségével azonban nem lehetett megmagyarázni az atomok spektrumvonalait.
Rutherford kísérlete
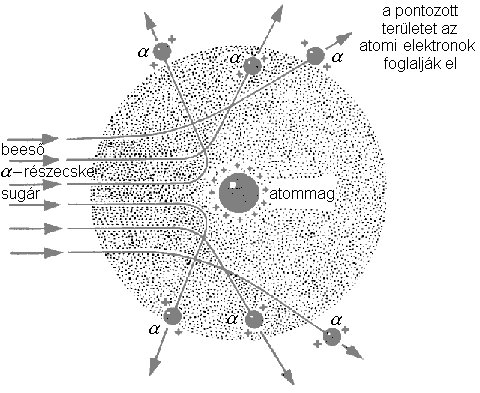
Rutherford 1909 és 1911 közt végzett kísérletei jelentős mértékben hozzájárultak az atom szerkezetének megismeréséhez. Híressé vált szórási kísérletében  részecskékkel bombázott aranyfóliát. A fólián szóródott részecskéket szcintillációs ernyőn detektálták. Az
részecskékkel bombázott aranyfóliát. A fólián szóródott részecskéket szcintillációs ernyőn detektálták. Az  részecskék nagy része akadálytalanul áthatolt az aranyfüstlemezen, egy részük eltérül, és volt néhány részecske (kb. minden 10000-dik), amely közel 180 fokos eltérülést szenvedett. Az eredményt nem lehetett a Thomson-modellel magyarázni. Rutherford a kísérletekből arra következtetett, hogy az
részecskék nagy része akadálytalanul áthatolt az aranyfüstlemezen, egy részük eltérül, és volt néhány részecske (kb. minden 10000-dik), amely közel 180 fokos eltérülést szenvedett. Az eredményt nem lehetett a Thomson-modellel magyarázni. Rutherford a kísérletekből arra következtetett, hogy az 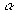 részecske egy igen kis térrészben koncentrált pozitív töltésű részecskével ütközik, hiszen csak minden 10000-dik alkalommal figyelhető meg ez a jelenség. Ez a részecske nagy tömegű az
részecske egy igen kis térrészben koncentrált pozitív töltésű részecskével ütközik, hiszen csak minden 10000-dik alkalommal figyelhető meg ez a jelenség. Ez a részecske nagy tömegű az 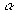 részecskéhez képest, mert csak így tud róla "visszapattanni".
részecskéhez képest, mert csak így tud róla "visszapattanni".
Rutherford modellje
Tehát az atom tömegének legnagyobb része (99,98 %-a) egy kicsi magban koncentrálódik.
Rutherford az atom méretét 10-10 m nagyságrendűnek becsülte, míg az atommagét ennél 10000-szer kisebbnek, 10-15-10-14 m-nek. Ez azt jelenti, hogy az atom belül szinte üres, hiszen az atommag nagyon kicsiny térrészben koncentrálódik. Az atommag sűrűsége kb. 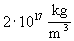 . Ebből az anyagból 1 cm3 -nyit véve, tömege megegyezne egy 300 m oldalélű vaskockáéval, ez több mint 200 millió tonna.
. Ebből az anyagból 1 cm3 -nyit véve, tömege megegyezne egy 300 m oldalélű vaskockáéval, ez több mint 200 millió tonna.
Rutherford atommodellje olyan, mint egy miniatűr Naprendszer, melynek középpontjában az atommag áll és körülötte keringenek az elektronok, mint a Nap körül a bolygók. Ha az atom méretarányairól akarunk képet alkotni, akkor képzeljük a magot borsószem nagyságúnak. Ebben az esetben az elektronok 250 m sugarú körpályán keringenek körülötte.
"Határozottan ez volt a leghihetetlenebb esemény, amellyel életemben találkoztam. Majd-nem olyan hihetetlen volt, mintha valaki egy 15 hüvelykes gránáttal egy selyempapír-darabkára tüzelne, és az visszatérve őt magát találná el."
Rutherford megállapította, hogy az atom pozitív magtöltéseinek száma azonos az elem periódusos rendszerbeli rendszámával. Atommodelljével a legfőbb probléma az volt, hogy az elektrodinamika törvényei szerint a mag körül keringő elektronnak sugároznia kellene. Ekkor viszont csökkenne az energiája és a magba kellene zuhannia. Ezt az ellentmondást csak Bohr tudta feloldani.