Az ókor (Kr.e.V.század)
"Empedoklésznek is körülbelül úgy kell szólnia, ahogyan Leukipposz beszél. Vannak bizonyos szilárd függőek. Márpedig ez lehetetlen, hiszen ez esetben semmi szilárd nem lehet a pórusok mellett, hanem a Mindenség egyetlen Űr volna. Szükséges tehát, hogy egyrészt legyenek egymással érintkező, oszthatalan (szilárd részecskék), másrészt legyenek köztük üregek, melyeket Empedoklész pórusoknak nevez.
...Démokritosz és Leukipposz, akik az alakzatokat (az atomokat) kitalálták, ezekből magyarázzák a változást és a keletkezést: a keletkezést és pusztulást egyesülésük és szétválásuk által, a minőségi változást pedig rendjük és helyzetük segélyével" (Arisztotelész - Kövendi Dénes fordítása)
A XIX.század
1801-ben Proust felfedezi az állandó súlyviszonyok elvét,
1808-ban Dalton közzé teszi a többszörös súlyviszonyok elvét.
Állandó súlyviszonyok elve: a kémiai reakciókban részt vevő anyagok csak meghatározott tömegarányban reagálnak maradéktalanul egymással.
Többszörös súlyviszonyok elve: ha két elem pl. A és B, többféleképpen is vegyül egymással, akkor az A elem azon mennyiségei, amelyek a B egy adott mennyiségével maradéktalanul reagálni képesek, úgy aránylanak egymáshoz, mint a kis egész számok.
1811-ben Avogadro megfogalmazza törvényét, mely szerint különböző gázok egyenlő térfogataiban azonos nyomás és hőmérséklet esetén a molekulák száma a gáz anyagi minőségétől függetlenül egyenlő. Később kiderült, hogy az állítás nemcsak gázokra igaz. Bármilyen elemből/anyagból az atom/molekulatömegével azonos mennyiséget véve, azok mindig ugyanannyi részecskét tartalmaznak. Ezt a számot Avogadro-számnak nevezték el. Értéke: 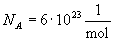
1833 és 1837 között Faraday leírja az elektrolízisre vonatkozó törvényeit.
Első törvénye szerint az elektrolízis során az elektródokon kiváló anyagok mennyisége az elektroliton áthaladt töltés mennyiségével arányos. A törvény szerint Q töltés hatására az elektrolitból 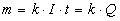 tömeg válik ki, ahol k az anyagtól függő állandó, az ú.n. elektrokémiai egyenérték. k azt mutatja meg, hogy 1 C töltés hatására hány mg anyag válik ki.
tömeg válik ki, ahol k az anyagtól függő állandó, az ú.n. elektrokémiai egyenérték. k azt mutatja meg, hogy 1 C töltés hatására hány mg anyag válik ki.
Második törvénye szerint a különböző anyagok elektrokémiai egyenértékei úgy aránylanak egymáshoz, mint kémiai egyenértéksúlyaik. Egy anyag kémiai egyenértéksúlyán atomsúlyának és vegyértékének hányadosát értjük.
A tapasztalat szerint 1 mol egy vegyértékű anyag kiválasztásához F =96500 C töltés szükséges. Az F mennyiséget Faraday-állandónak nevezik.
Faraday a törvényei alapján arra következtetett, hogy az elektromosság is elemi részecskékből áll, amelyek töltése: 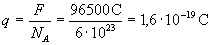 .
.
1858-ban Plücker katódsugarakat állít elő kisülési csőben. Ha a kisülési csőben a gáz nyomását pár Pa-ra csökkentjük, akkor a katódból egy láthatatlan sugárzás, a katódsugárzás indul ki. Ezt a katódba becsapódó pozitív ionok váltják ki. A sugárzás hatására a kisülési cső zöldes színben fluoreszkál.
A katódsugárzás tulajdonságai:
- jellemzői függetlenek a katód és a töltőgáz anyagától
- a katódból merőlegesen lép ki
- egyenes vonalban terjed
- a gázokat ionizálja
- több anyagon fluoreszcenciát okoz
- mágneses térben eltéríthető
- sebessége
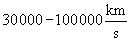 , amely az elektródok közti feszültségtől függ
, amely az elektródok közti feszültségtől függ
- az élő szervezetre roncsoló hatású
1869-ben Mengyelejev megszerkeszti az elemek periódusos rendszerét. Ennek alapja az a felismerés, hogy az elemek kémiai tulajdonságai az atomsúly növekedésével periodicitást mutatnak. Mengyelejev eszerint rendezte táblázatba őket. Megjósolta, hogy az üresen maradt cellákba majd megfelelő tulajdonságú elemek írhatók. Így pl. a később felfedezett germánium tulajdonságait már előre ismerték. Mengyelejevtől függetlenül, 1869-ben a német kémikus, Lothar Meyer is magyarázatot adott az elemek tulajdonságainak periodicitására, de nem olyan mélységben, mint Mengyelejev.
"Ha az elemeket függőleges oszlopokban rendezzük el növekvő atomsúly szerint úgy, hogy a vízszintes sorok analóg elemeket tartalmazzanak ismét csak növekvő atomsúlyuknak megfelelően, olyan elrendezést kapunk, amelyből több általános következtetést vonhatunk le.
- Az atomsúlyuk nagysága szerint elrendezett elemek tulajdonságaik periodikus váltakozását mutatják.
- Kémiailag hasonló elemek atomsúlya vagy igen közel esik egymáshoz (Pt, Ir, Os), vagy azonos nagysággal növekszik (K, Rb, Cs).
- Az atomsúlyok szerinti elrendezés megfelel az elemek valenciájának és bizonyos fokig a kémiai viselkedésükben mutatott különbségnek; például Li, Be, B, C, N, O, F.
- A természetben leggyakrabban előforduló elemeknek kicsi az atomsúlyuk, és mindegyik ilyen elem jellegzetes viselkedésével tűnik ki. Ilyen módon ezek típusoknak tekinthetők, és a legkönnyebb elem, a hidrogén jogosan szerepel mint a tömeg egysége...
...
- Sok új elem felfedezését megjósolhatjuk; például a Si és Al analóg elemeit a 65 és 75 atomsúly között.
- Néhány atomsúlyt feltehetőleg korrigálni kell. Például a Te atomsúlya nem lehet 128, hanem 123 és 126 közé kell esnie.
- A táblázatból új hasonlóságok is leolvashatók; így az U a Bo és Al analogonjaként jelentkezik, ez egybevág a kísérleti eredményekkel."
(Mengyelejev 1869-ben orosz nyelven írt cikkének a Zeitschrift für Chemie-ben megjelent kivonatából)
1895-ben Röntgen felfedezi a róla elnevezett sugárzást. A katódsugárzás vizsgálatakor észrevette, hogy a kisülési cső közelében lévő só fluoreszkál. Ha a csövet fekete papírral letakarta, hogy ne jusson látható fény a sóra, az akkor is fluoreszkált. Így arra következtetett, hogy mindennek egy eddig ismeretlen, általa X-sugárzásnak nevezett jelenség az oka.
" Egy további, méghozzá igen fontos különbség a katódsugarak és az X-sugarak között abban a tényben van, hogy nem sikerült, ismételt próbálkozásaim ellenére sem, az X-sugarakat mágnessel eltéríteni még igen intenzív terekben sem. ...az X-sugarak nem lehetnek azonosak a katódsugarakkal, hanem őket éppen a katódsugarak hozzák létre a kisülési cső üvegfalán." (Röntgen)
A röntgensugarak további vizsgálata során kiderült, hogy elektromágneses természetűek (nem téríthetők el mágneses mezőben), tehát fotonok áramát jelentik. Ezek energiája igen nagy, hiszen a sugárzás áthatolóképessége is az. Frekvenciájuk a 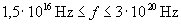 tartományba esik, hullámhosszuk pedig a
tartományba esik, hullámhosszuk pedig a 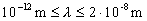 intervallumba. A sugárzás egyenes vonalban, fénysebességgel terjed.
intervallumba. A sugárzás egyenes vonalban, fénysebességgel terjed. 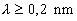 : lágy sugárzás,
: lágy sugárzás, 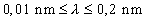 : közép-kemény sugárzás,
: közép-kemény sugárzás, 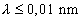 : kemény sugárzás (az anód - katód feszültséggel változtatható).
: kemény sugárzás (az anód - katód feszültséggel változtatható).
A röntgensugárzás tulajdonságai:
- a katódsugárcső anódjából lép ki merőlegesen, a becsapódó elektronok hatására
- egyenes vonalban terjed
- a gázokat ionizálja
- több anyagon fluoreszcenciát okoz
- mágneses térben nem téríthető el, hiszen fotonokból áll
- megfeketíti a fotopapírt
- fénysebességgel halad
- az élő szervezetre roncsoló hatású, ólomruhával lehet védekezni ellene
Röntgen-sugárzás előfordul a természetben is (pl. a kozmikus sugárzásban). Keletkezésének feltétele, hogy megfelelően nagy energiájú elektronok ütközzenek valamilyen anyagnak.
Alkalmazásai:
- orvosi átvilágítás
- anyagvizsgálat
1897-ben J.J.Thomson megállapítja, hogy a katódsugárzás negatív töltésű részecskékből áll, amelyeket elektronnak nevez el.
"... a katódsugarak az anyag új állapotát jelentik, egy olyan állapotot, amelyben az anyag részekre bomlása sokkal magasabb fokú, mint a közönséges gázállapotban: ez egy olyan állapot, amelyben minden anyag - származzon az hidrogénből, oxigénből vagy bármely más forrásból - már egy és ugyanazon fajta; lévén ez az a szubsztancia, amelyből az összes kémiai elem felépül." (Thomson)
A katódsugárzás legelterjedtebb alkalmazása a televízió képcsövében valósult meg, ami nem más, mint egy katódsugárcső. Az izzó katódból kilépő elektronokat a katód és anód közé kapcsolt feszültség felgyorsítja. Ezután az elektronsugarat két, egymásra merőleges kondenzátorral tudják eltéríteni vízszintes vagy függőleges irányban. A kondenzátor lemezei közt lévő elektromos tér ugyanis erőhatást gyakorol az elektronokra. A kondenzátorok helyett gyakoribb az eltérítőtekercsek használata. Ezek mágneses tere a Lorentz-erő révén kormányozza a megfelelő irányba az elektronokat. A fluoreszkáló ernyőbe becsapódó elektronok pedig felvillantják a szükséges képpontokat a hozzá rendelt fényerősséggel.