A Bohr-féle atommodell (1913)
A Rutherford-féle atommodell nem volt összeegyeztethető a klasszikus elektrodinamika törvényeivel (az atommag körül keringő elektronnak elektromágneses hullámokat kellene kisugároznia, így energiája csökkenne, végül a magba zuhanna). A problémát Bohrnak sikerült megoldania hipotézisei segítségével:
1. Az atom elektronjai csak meghatározott pályákon keringhetnek a mag körül. Ezeken a pályákon - ellentétben a klasszikus elektrodinamika törvényeivel - az elektron nem sugároz.
2. Az atom csak akkor sugároz, ha az elektron az egyik pályáról a másikra ugrik. Ilyenkor energiáját egy foton formájában bocsátja ki. Ennek frekvenciáját a ![]() egyenlet határozza meg, ahol a jobb oldalon szereplő mennyiségek az egyes pályákhoz tartozó energiák. Fordítva: az atom csak olyan foton befogására képes, amelynek energiája éppen egyenlő két pályaenergia különbségével.
egyenlet határozza meg, ahol a jobb oldalon szereplő mennyiségek az egyes pályákhoz tartozó energiák. Fordítva: az atom csak olyan foton befogására képes, amelynek energiája éppen egyenlő két pályaenergia különbségével.
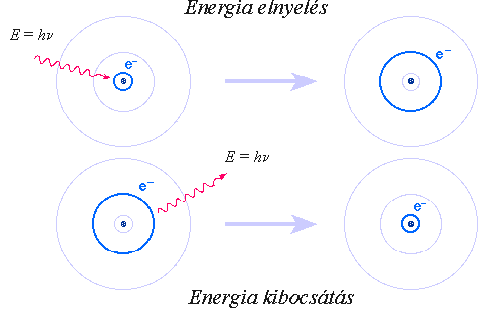
A hidrogénatom
A Bohr-féle atommodell szerint a hidrogénatomban is különböző energiájú pályákon helyezkedhet el az elektron. Az egyes pályákat n = 1, 2, 3, ... sorszámmal láthatjuk el. Ezeket főkvantumszámoknak nevezzük. Egy adott n főkvantumszámú pályán lévő elektron energiája:
![]()
A negatív előjel azért szükséges, mert az elektron az atomban kötött állapotban van, ezért energiája kisebb 0-nál.
R az ún. Rydberg-állandó, értéke: ![]() .
.
Gerjesztett állapotban (n = 2, 3, 4...) az elektron legfeljebb 10-8 s-ig van. A magasabb energiájú pályákról az n = 1 főkvantumszámú pályára való visszaugrások során kibocsátott foton energiáit az ún. Lyman-series mutatja meg. n = 2 esetén ezt a sorozatot Balmer-seriesnek, n = 3 esetén Paschen-seriesnek, n = 4 esetén Brackett-seriesnek, n = 5 esetén pedig Pfund-seriesnek nevezzük.
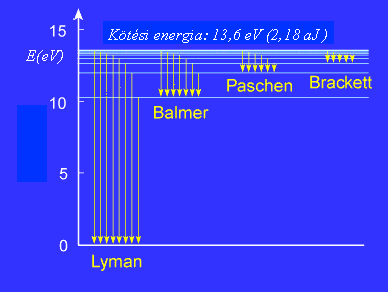
Energiaátmenetek a hidrogén atomban
Ha az elektron az n. pályáról az m. pályára "ugrik" vissza, akkor az általa kisugárzott energia:
![]()
A kisugárzott foton energiáját pedig az 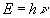 képletből kapjuk. Azt az energiát, amelyet akkor sugározna az elektron, ha végtelen távolról zuhanna vissza alapállapotba, kötési energiának nevezzük, hiszen ugyanennyi energiára lenne szükség akkor is, ha az elektront el akarnánk szakítani a magtól.
képletből kapjuk. Azt az energiát, amelyet akkor sugározna az elektron, ha végtelen távolról zuhanna vissza alapállapotba, kötési energiának nevezzük, hiszen ugyanennyi energiára lenne szükség akkor is, ha az elektront el akarnánk szakítani a magtól.
A hidrogén elektronjának kötési energiája:
![]()
A Franck-Hertz-féle kísérlet
Bohr atommodelljével azonos évben, de tőle függetlenül született meg legközvetlenebb bizonyítéka. Franck és Hertz kis nyomású, higanygőzt tartalmazó vákuumtriódában vizsgálták az elektronok és a higanyatomok ütközését.
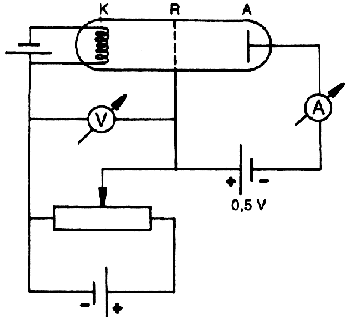
Az izzókatódból kilépő elektronokat a rács és a katód közé kapcsolt rácsfeszültség segítségével gyorsították. Ekkor az 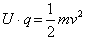 egyenletből számolható ki, hogy mekkora sebességre tesznek szert a rácshoz érkezve. Az elektronok a rácson áthaladva a rács és anód közti térben ütközhetnek a higanyatomokkal. A rács és az anód közé kapcsolt anódfeszültség ellentétes a rácsfeszültséggel, tehát a rácson túl az elektronok sebessége csökken. A becsapódó elektronok áramát, az anódáramot az anódkörbe kapcsolt műszer méri. Ha az anódfeszültség elegendően nagy, akkor az elektronok összes energiáját felemészti, és azok így nem csapódhatnak be az anódba.
egyenletből számolható ki, hogy mekkora sebességre tesznek szert a rácshoz érkezve. Az elektronok a rácson áthaladva a rács és anód közti térben ütközhetnek a higanyatomokkal. A rács és az anód közé kapcsolt anódfeszültség ellentétes a rácsfeszültséggel, tehát a rácson túl az elektronok sebessége csökken. A becsapódó elektronok áramát, az anódáramot az anódkörbe kapcsolt műszer méri. Ha az anódfeszültség elegendően nagy, akkor az elektronok összes energiáját felemészti, és azok így nem csapódhatnak be az anódba.
Azt tapasztalták, hogy a rácsfeszültség növelésével az anódáram egy ideig nő, majd egy adott értéknél erősen lecsökken. Ezután ismét nőni, kezd, majd újra csökken, folytatva ezt a tendenciát. Higany esetén 4,9 V-os és 9,8 V-os rácsfeszültségnél csökken le erősen az anódáram, vagyis az elektronok nagy része nem ér el az anódra. Ennek magyarázata, hogy ebben az esetben a higanyatomok elnyelik az elektronok energiáját, szemléletesen "rugalmatlanul ütköznek " velük. Ezektől eltérő rácsfeszültség esetén az ütközés rugalmas. A rugalmas ütközések után az elektronok folytatják útjukat az anód felé, amelybe becsapódnak. Ez egyértelműen bizonyítja, hogy a higanyatomok csak meghatározott energiákat képesek elnyelni (a 4,9 ill. a 9,8 V feszültséggel felgyorsított elektronokét). Ezek az energiaadagok éppen akkorák, mint az atom két különböző pályán lévő elektronjának energiakülönbsége.
A kísérletért Franck és Hertz 1925-ben Nobel díjat kapott.
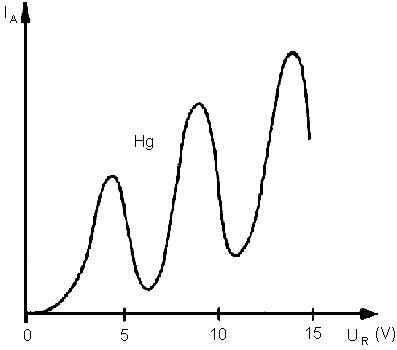
Az anódáram a rácsfeszültség függvényében